مراجعة الفصل الثاني
املأ الفراغ فيما يلي بالكلمة المناسبة:
1. قيمة الرقم الهيدروجيني للقاعدة أكثر من 7.
2. كمية المذاب في محلول تمثل التركيز.
3. كمية المذاب التي تذوب في 100 جرام من المذيب تمثل الذائبية.
4. المذاب مادة تذوب لتكوين محلول.
5. التفاعل بين حمض وقاعدة يسمى التعادل.
6. المادة النقية لها تركيب ثابت.
اختر الإجابة الصحيحة فيما يلي:
7. أي مما يلي محلول؟
أ. الماء النقي.
ب. كعكة الزبيب.
ج. النحاس.
د. الخل.
8. أي نوع من المركبات التالية لا يذوب في الماء؟
أ. القطبية.
ب. الأيونية.
ج. غير القطبية.
د. المشحونة.
9. ما نوع جزيء الماء؟
أ. قطبي.
ب. أيوني.
ج. غير قطبي.
د. راسب.
10. ماذا يمثل الماء عند إذابة مركبات الكلور في ماء التربة؟
أ. السبيكة.
ب. المذيب.
ج. المحلول.
د. المذاب.
11. أي مما يلي يمكن التقليل منه للحد من ذوبان المادة الصلبة في السائل؟
أ. حجم الجزيئات.
ب. الضغط.
ج. درجة الحرارة.
د. حجم العبوة.
12. أي الأحماض التالية يستخدم في العمليات الصناعية لتنظيف الفلزات؟
أ. الهيدروكلوريك.
ب. الكربونيك.
ج. الكبريتيك.
د. النيتريك.
13. إذا تم تحضير محلول بإضافة 100 جرام من هيدروكسيد الصوديوم الصلب NnOH إلى 1000 مل ماء فماذا تمثل المادة الصلبة NnOH؟
أ. محلول.
ب. مذاب.
ج. مذيب.
د. مخلوط.
14. أي التراكيز المتساوية الآتية ينتج أيونات هيدرونيوم أكثر في محلول مائي؟
أ. القاعدة القوية.
ب. القاعدة الضعيفة.
ج. الحمض القوي.
د. الحمض الضعيف.
15. العصارة الصفراء سائل حمضي يفرزه الجسم للمساعدة على الهضم وتركيز أيونات الهيدرونيوم فيه عال ما الرقم الهيدروجيني المتوقع له؟
أ. صفر.
ب. 7.
ج. أقل من 7.
د. أكبر من 7.
16. ما الذي يحدث لحمض معدتك عندما تبتلع حبة مضاد للحموضة؟
أ. يصبح أكثر حمضية.
ب. يصبح أكثر قاعدية.
ج. يخفف.
د. يتعادل.
17. وضح ظروف تكون البلورات والرواسب في المحاليل.
تتكون البلورات في المحاليل تحت ظروف محددة فتخرج كمية من المذاب خارج المحلول في صورة مادة صلبة وتحدث عملية التبلور أحياناً عند تبريد المحلول أو عند تبخر جزء من المذنب، أما تكون الرواسب فيحدث عند خلط المحاليل وتفاعل المواد فيما بينها فيتكون مادة صلبة تسمى راسب.
18. وضح كيف تحصل على محلول مخفف من حمض قوي؟
بإذابة كمية قليلة من الحمض في كمية كبيرة من الماء ليصبح المحلول مخففاً.
19. استخلص النتائج يضاف مانع التجمد في مبرد السيارة (الرادياتير) لمنع تجمد الماء في أشهر البرد، ويقوم أيضاً بمنع غليان الماء أو ارتفاع درجة حرارته فوق درجة الغليان كيف يقوم بذلك؟
لأن مانع التجمد يعمل كمذاب أما الماء فيعمل كمذيب فيغير المذاب من خواص المذيب (الماء) الفيزيائية فيغير من درجة تجمد الماء ودرجة غليانه.
استخدم التوضيح التالي للإجابة عن السؤال 20.
20. فسر يستخدم الكيميائيون كواشف مختلفة من المهم استخدام الكاشف الصحيح، حيث يتغير اللون عند الرقم الهيدروجيني المناسب، وإلا كانت النتيجة مضللة اعتماداً على الشكل، ما الكواشف التي تستخدم ليتغير اللون عند كل من القيمتين 8و 2؟
الكر يسول الأحمر والثيمول الأزرق والكاشف العالمي.
21. وضح يمكن لجزيئات الماء أن تنفصل إلى أيونات H+ وOH- ومن المعلوم أن الماء مادة مترددة أي يمكن أن تمثل حمضاً أحياناً وقاعدة أحياناً أخرى.
يعمل الماء كحمض أحياناً حيث يقوم بإنتاج أيونات الهيدرونيوم كما أنه يعمل كقاعدة في بعض الأحيان حيث ينتج أيونات الهيدروكسيد.
22. صف كيف يتكون محلول (سائل - صلب)؟ وكيف يختلف هذا المحلول عن محلول (سائل - غاز)؟ وكيف يختلف هذان الاثنان عن محلول (سائل - سائل)؟ أعط مثالاً على كل نوع.
محلول (سائل - صلب) يتكون بإذابة مادة صلبة في مذيب سائل مثل الماء والملح أما في محلول (سائل - غاز) يكون المذيب سائل بينما المذاب غاز مثل المشروب الغازي، أما في محلول سائل (فإن كل من المذيب والمذاب مادة سائلة مثل الخل).
23. قارن بين المخاليط المتجانسة والمخاليط غير المتجانسة من خلال مخاليط مستخدمة في الحياة.
| سلطة الخضار | الشامبو |
| مخلوط غير متجانس | مخلوط متجانس |
| تتوزع مكونات السلطة بغير انتظام | تتوزع مكوناته بانتظام |
| يمكن فصل مكوناتها بسهولة | يصعب فصل مكوناته |
24. كون فرضية يفور الشراب الغازي الدافئ أكثر من البارد عند فتح علبته فسر ذلك معتمداً على ذائبية ثاني أكسيد الكربون في الماء.
لأنه بارتفاع درجة الحرارة تقل ذائبية الغاز في السائل ولذلك يتحرر غاز ثاني أكسيد الكربون من الشراب الدافئ بكمية أكبر منها في الشراب البارد.
25. كتابة مقالة توضح فيها الاختلاف بين المادة النقية والمخلوط
- المادة النقية: لها نفس الخصائص والتركيب ولا يمكن تجزئتها إلى مواد أبسط منها، قد تكون في صورة عناصر مثل الأوكسجين أو مركبات لها تركيب ثابت أي أن النسبة بين ذرات العناصر المكونة للمركب ثابتة مثل الماء.
- المخلوط: مكون من مواد غير مترابطة بنسب غير محددة ويمكن فصل مكوناتها بإحدى الطرق الفيزيائية مثل استخدام المغناطيس في فصل برادة الحديد من الرمل.
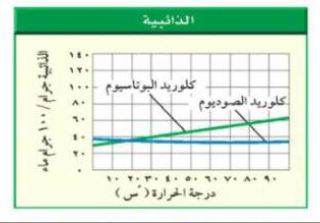
استخدم الشكل أدناه للإجابة عن السؤال 26.
26. الذائبية مستخدماً الرسم البياني للذائبية أعلاه قدر ذائبية كل من كلوريد البوتاسيوم وكلوريد الصوديوم في الماء عند 80ْس.
- كلوريد البوتاسيوم 60جم / 100 جم ماء.
- كلوريد الصوديوم 35جم / 100 جم ماء.
27. تركيز العصير إذا عملت شراباً في وعاء سعته 1000 مل فما حجم مسحوق العصير الذي وضعته فيه لتكون نسبة العصير في الشراب 18%؟
المعطيات: سعة الوعاء = 1000 مل
نسبة العصير في الشراب = 18%
طريقة الحل:
حجم مسحوق العصير = (1000×18) /100=180 مل.


.JPG)
.JPG)
.JPG)

.JPG)
.JPG)