اختبار مقنن
اختر رمز الإجابة الصحيحة فيما يأتي:
1. يتحد الصوديوم مع الفلور لتكوين فلوريد الصوديوم (NaF) وهو مكون أساسي في معجون الأسنان في هذه الحالة يكون للصوديوم التوزيع الإلكتروني المماثل لعنصر:
ا. النيون.
ب. الليثيوم.
ج. الماغنسيوم.
د. الكلور.
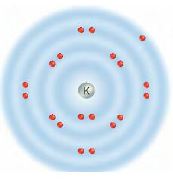
استعن بالرسم التالي للإجابة عن السؤالين 2 و3.
2. يوضح الرسم أعلاه التوزيع الإلكتروني للبوتاسيوم، فكيف يصل إلى حالة الاستقرار؟
أ. يكتسب إلكتروناً.
ب. يفقد إلكتروناً.
ج. يكتسب إلكترونين.
د. يفقد إلكترونين.
3. ينتمي عنصر البوتاسيوم إلى عناصر المجموعة 1 من الجدول الدوري فما اسم هذه المجموعة؟
أ. الهالوجينات.
ب. الغازات النبيلة.
ج. الفلزات القلوية.
د. الفلزات القلوية الترابية.
4. ما نوع الرابطة التي تربط بين ذرات جزيْ غاز النيتروجين (N2)؟
أ. أيونية.
ب. ثنائية.
ج. احادية.
د. ثلاثية.
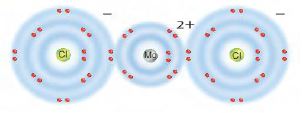
استخدم الرسم التالي للإجابة عن السؤالين 5 و6.
5. يوضح الرسم أعلاه التوزيع الالكتروني لكلوريد الماغنسيوم فما الصيغة الكيميائية الصحيحة لهذا المركب؟
أ. Mg2Cl.
ب. MgCl.
ج. MgCl2.
د. Mg2Cl2.
6. ما نوع الرابطة التي تربط بين عناصر مركب كلوريد الماغنسيوم؟
أ. أيونية.
ب. فلزية.
ج. قطبية.
د. تساهمية.
7. ما أكبر عدد من الإلكترونات يمكن أن يستوعبه مجال الطاقة الثالث في الذرة؟
أ. 8
ب. 18
ج. 16
د. 24
استعن بالصورة التالية للإجابة عن السؤالين 8 و9.
8. توضح الصورة أعلاه عملية تفاعل النحاس Cu مع نترات الفضة AgNO3 لتكوين نترات النحاس 2( Cu(No3 والفضة Ag حسب المعادلة التالية:
ما المصطلح الذي يصف هذا التفاعل:
أ. عامل محفز.
ب. تغير كيميائي.
ج. عامل مثبط.
د. تغير فيزيائي.
9. ما المصطلح الأنسب الذي يصف الفضة في التفاعل؟
أ. متفاعل.
ب. عامل محفز.
ج. انزيم.
د. ناتج.
10. ما المصطلح الذي يصف الحد الأدنى من الطاقة اللازمة لبدء التفاعل؟
أ. عامل محفز.
ب. سرعة التفاعل.
ج. طاقة التنشيط.
د. الإنزيمات.
11. ما الذي يجب موازنته في المعادلة الكيميائية.
أ. المركبات.
ب. الذرات.
ج. الجزيئات.
د. الجزيئات والذرات.
استعن بالصورة التالية للإجابة عن السؤالين 12 و13.
12. توضح الصورة أعلاه عملية التحليل الكهربائي للماء حيث يتفكك جزيء الماء إلى هيدروجين وأوكسجين أي المعادلات الآتية يعبر بصورة صحيحة عن هذه العملية؟
أ.
ب.
ج.
د.
13. كم ذرة هيدروجين نتجت بعد حدوث التفاعل مقابل كل ذرة هيدروجين وجدت قبل التفاعل؟
أ. 1
ب. 2
ج. 4
د. 8
14. ما أهمية المثبطات في التفاعل الكيميائي؟
أ. تقلل من فترة صلاحية الطعام.
ب. تزيد من مساحة السطح.
ج. تقلل من سرعة التفاعل الكيميائي.
د. تزيد من سرعة التفاعل الكيميائي.
15. ما السحابة الإلكترونية؟
الفراغ المحيط بالنواة، الذي تتحرك فيه الإلكترونات.
16. بين الخطأ في العبارة الآتية:
جميع الروابط التساهمية بين الذرات روابط قطبية لأن كل عنصر يختلف قليلاً في قدرته على جذب الإلكترونات أعط مثالاً يدعم إجابتك.
لا تراعي العبارة حالة الرابطة التساهمية بين الذرات المتشابهة كجزيء N2 مثلاً، فهي غير قطبية لأن كلتا الذرتين لها القدرة نفسها على جذب الإلكترونات.
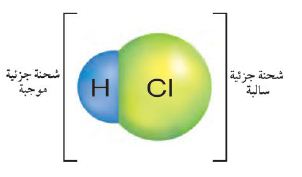
استخدم الرسم التالي للإجابة عن السؤالين 17 و18.
17. يوضح الرسم أعلاه كيف يرتبط الهيدروجين والكلور معاً ليكونا جزيئاً قطبياً وضح لماذا تكون الرابطة بينهما قطبية؟
لأن الكلور يجذب الإلكترونات بشكل أكبر من الهيدروجين.
18. ارسم التمثيل النقطي لإلكترونات الجزيء الموضح في الرسم التوضيحي أعلاه.
19. ما اسم المجموعة 17 من الجدول الدوري؟
الهالوجينات.
20. اذكر اختلافين بين الإلكترونات التي تدور حول النواة والكواكب التي تدور حول الشمس؟
ليس للكواكب شحنات، ولكن لنواة الذرة شحنة موجبة وللإلكترونات شحنة سالبة، وتتحرك الكواكب بمدارات يمكن التنبؤ بها بينما لا يمكن تحديد موقع الإلكترونات.
21. ما عائلة العناصر التي كانت معروفة باسم الغازات الخاملة؟ ولم تم تغير الاسم؟
كانت الغازات النبيلة تدعى الغازات الخاملة، وقد تغير الاسم بعد اكتشاف العلماء أن بعض هذه الغازات يمكن أن تتفاعل.
22. إذا تغير حجم المادة ولم تتغير أي خاصية أخرى لها فهل يعد هذا تغيراً فيزيائياً أم تغيراً كيميائياً؟ وضح اجابتك.
تغيراً فيزيائياً، لأنه لم يطرأ أي تغيير على المواد المتفاعلة.
استخدم المعادلة الكيميائية الآتية للإجابة عن السؤال 23.
23. عند مزج محلولين من كلوريد الكالسيوم ونترات الفضة معاً تنتج نترات الكالسيوم وراسب أبيض حدد الصيغة الكيميائية لهذا الراسب؟
الراسب هول كلوريد الفضة AgCl
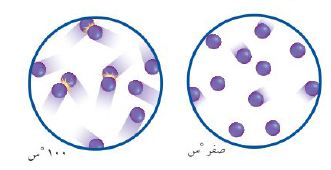
استخدم الشكل التالي للإجابة عن السؤالين 24 و25.
24. يوضح الشكل أعلاه حركة الذرات عند صفر ْ س و100ْ س ماذا يحدث لحركة الذرات إذا انخفضت درجة الحرارة إلى ما دون الصفر سْ.
ستقل سرعة الذرات، ولكنها لن تتوقف نهائياً عن الحركة.
25. صف. كيف يؤثر الاختلاف في حركة الذرات عند درجتي حرارة مختلفتين في سرعة التفاعلات الكيميائية؟
تزداد سرعة معظم التفاعلات الكيميائية عند ارتفاع درجات الحرارة، وكلما كانت حركة الجزيئات والذرات سريعة كانت الفرصة أكبر لتصادمها معاً.
26. هل طاقة التنشيط ضرورية للتفاعلات الطاردة للطاقة؟ وضح اجابتك.
نعم، فبالرغم من أن التفاعلات تحرر طاقة فيما بعد إلا أنها تحتاج إلى طاقة تنشيط لبدئها.
27. تنفذ الكثير من التجارب العلمية في بيئة خالية من الأوكسجين لهذا تجرى مثل هذه التجارب في أوعية مليئة بغاز الأرجون، صف توزيع الإلكترونات في ذرة الأرجون ولماذا يعد الأرجون عنصراً ملائماً لمثل هذه التجارب.
للأرجون 18 الكتروناً، ثمانية منها في مستوى الطاقة الخارجي، فيكون بذلك ذرة مستقرة، مما يعني أنه لن يتفاعل مع العناصر المحيطة به، مما يجعله مناسباً للاستخدام في التجارب.
28. أي المجموعات في الجدول الدوري تسمى الهالوجينات؟ صف التوزيع الإلكتروني لعناصرها ونشاطها الكيميائي واذكر عنصرين ينتميان إلى هذه المجموعة؟
عناصر المجموعة 17 حيث لها 7 الكترونات في مستوى الطاقة الخارجي، فتحتاج إلى إلكترون واحد لكي تصل إلى حالة الاستقرار وهي ترتبط بسهولة مع عناصر المجموعة 1 التي تفقد إلكترونها بسهولة ومنها الفلور والكلور والبروم واليوم والأسسيتين.
29. ما الرابطة الأيونية؟ صف كيف تنشأ الرابطة الأيونية في مركب كلوريد الصوديوم؟
الرابطة الأيونية قوى جذب بين الأيون الموجب والأيون السالب وعندما يتحد الصوديوم والكلور يفقد الصوديوم إلكتروناً ليصبح أيون موجباً، بينما يكتسب الكلور الإلكترون ليصبح أيوناً سالباً لهذا تسمى الرابطة بينهما رابطة أيونية.
30. ما المقصود بالرابطة الفلزية؟ وكيف تؤثر في خصائص الفلزات؟
تكون الإلكترونات في المستوى الخارجي للذرات الفلزية غير مرتبطة بقوة في الذرة، وتتحرك بحرية خلال الأيونات في الفلز، وتنشأ الرابطة الفلزية بين الذرات التي لها هذه الإلكترونات القطبية، مما يسمح لانزلاق طبقات من الذرات بعضها فوق بعض، فتصبح قابلة للطرق والحسب وموصلة جيدة للكهرباء.
31. فسر وجود الجزيئات القطبية، وعدم وجود المركبات الأيونية القطبية.
جزيئات تعني مجموعة من ذرتين أو أكثر ترتبط معاً برابطة تساهمية أي أنها تتشارك بالإلكترونات وإذا كان التشارك غير متساو يكون المركب قطبياً وبما أن المركبات الأيونية لا تشارك بالإلكترونات فلا يمكن أن تكون قطبية.
استخدم الصورة التالية للإجابة عن السؤالين 32 و33.
32. اشرح ما يحدث في الصورة أعلاه ثم وضح ما قد يحدث إذا لامس البالون الماء؟
تظهر الصورة سيلاً من الماء المنسكب ينحرف نحو البالون بسبب قطبية جزيئات الماء، فالشحنات الموجبة لقطبي جزيئات الماء تنجذب نحو البالون السالب الشحنة فإذا لمس البالون الماء يفقد شجناته ولن يجذب الماء.
33. ارسم نموذجاً توضح فيه التوزيع الالكتروني لجزيء الماء، ووضح كيف يؤثر موقع الإلكترونات فيما يحدث في الصورة أعلاه
شارك الهيدروجين بالإلكترونات مع الأوكسجين وتبدو الإلكترونات أقرب إلى ذرة الأوكسجين منها إلى ذرة الهيدروجين، مما يجعل جزيء الماء قطبياً، فينجذب للبالون السالب الشحنة
استخدم الصورة التالية للإجابة عن السؤالين 34 و35.
34. توضح الصورة أعلاه غابة احترقت عندما ضرب البرق الشجر صف التفاعل الكيميائي الذي يحدث عند احتراق الشجر وهل هذا التفاعل الذي طارد أم ماص للطاقة؟ ما معنى ذلك؟ وكيف يؤدي هذا إلى انتشار اللهب؟
تتحد المواد في الغابة مع الأوكسجين لإنتاج طاقة حرارية وضوءاً وثاني أكسيد الكربون والماء ويعد الاحتراق من التفاعلات الطاردة للطاقة، فتحرر الطاقة الحرارية، التي تسبب اشتعال الأشجار وانتشار الحريق.
35. إن احتراق جذوع الأشجار تفاعل كيميائي، فما الذي يمنع حدوث هذا التفاعل الكيميائي عندما لا يكون هناك برق (تلقائياً)؟
قبل بدء التفاعل الكيميائي يجب أن تتصادم المواد المتفاعلة مع طاقة كافية لكسر الروابط الكيميائية بينها، وهذه الطاقة تسمى طاقة التنشيط للتفاعل ويمكن للبرق تزويد التفاعل بطاقة التنشيط اللازمة لتسبب احتراق الأشجار في الغابة.
36. فسر كيف يمكن لسطح المادة المعرض للتفاعل أن يؤثر في سرعة التفاعل بين مادة وأخرى؟ أعط أمثلة؟
يحدث التفاعل الكيميائي عند اتصال المواد المتفاعلة معاً، ويمكن للذرات أو الجزيئات في المستوى الخارجي من المواد المتفاعلة أن تتفاعل مع المواد المتفاعلة الأخرى، وللمواد ذات السطوح الكبيرة ذرات أو جزيئات أكثر يمكنها التفاعل مع المواد المتفاعلة الأخرى ومن الأمثلة على ذلك الفرق في التفاعل بين سلك المواعين وقضبان حديد البناء سيكون التفاعل في الصوف الصلب أكبر لأن مساحة الخيوط الرفيعة مع الحديد أكبر للتعرض والتفاعل مع الأوكسجين.
37. ومن التفاعلات التي تحدث في عملية تشكيل الزجاج اتحاد كربونات الكالسيوم والسليكا لتكوين سليكات وثاني أكسيد الكربون :
صف هذا التفاعل مستخدماً أسماء المواد الكيميائية ثم وضح أي هذه الروابط تم كسرها وكيفية ترتيب الذرات لتكوين روابط جديدة.
يتكون كربونات الكالسيوم من ذرة واحدة من الكالسيوم ترتبط مع ذرة واحدة من الكربون وثلاث ذرات من الأوكسجين وتتكون السليكا من ذرة واحدة من السيلكون مرتبطة مع ذرتين من الأوكسجين وخلال التفاعل يتم كسر هذه الروابط وانتاج روابط جديدة، تنفصل ذرة كربون مع ذرتي أوكسجين من كربونات الكالسيوم لتكون ثاني أكسيد الكربون وتتحد ذرة الكالسيوم المتبقية وذرة الأوكسجين مع السليكا لتكوين سليكات الكالسيوم.
مشاركة الدرس
الاختبارات
اختبار الوحدة8: اختبار مقنن
Warning (2): Undefined array key "percent_w" [APP/View/Elements/lesson/exams.ctp, line 20]" aria-valuemin="0" aria-valuemax="100">

.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)





النقاشات